Piles, accumulateurs et piles à combustible
I - Transformation chimique et générateurs électriques
Une pile est un dispositif électrochimique qui produit de l'électricité grâce à une réaction d'oxydo-réduction.
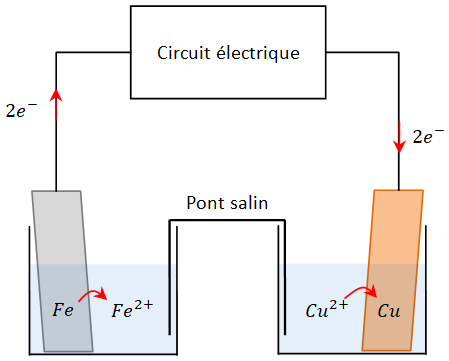
Fig. 1 – générateur électrochimique constitué de deux demi-piles.
| 1/2 équation électronique : | \(Fe \rightarrow Fe^{2+}+2 \text{ }e^{-}\) | |
| 1/2 équation électronique : | \(Cu^{2+}+2 \text{ }e^{-} \rightarrow Cu\) | |
| équation-bilan : | \(Fe + Cu^{2+} \rightarrow Fe^{2+} + Cu\) |
L'électrode de fer libère des électrons, c'est la borne négative de la pile. Le fer subit une oxydation. Cette électrode est l'anode de la pile.
L'électrode de cuivre capte des électrons, c'est la borne positive de la pile. Les ions cuivre subissent une réduction. L'électrode de cuivre est la cathode.
⇨ Dans la solution acqueuse de la demi-pile \(Fe/Fe^{2+}\) la concentration des ions \(Fe^{2+}\) augmente. Le rôle du pont salin est de rééquilibrer l'électroneutralité de la solution en libérant des ions négatifs.
A l'inverse, dans la solution acqueuse de la demi-pile \(Cu/Cu^{2+}\) la concentration des ions \(Cu^{2+}\) baisse. Le pont salin va donc rééquilibrer l'électroneutralité de la solution en libérant des ions positifs.
⇨ La pile est usée lorsque l'un des réactifs a été entièrement consommé. C'est une transformation irréverssible.
II - Accumulateurs
Un accumulateur électrochimique est un dispositif destiné au stockage de l'énergie électrique sous forme chimique. Contrairement à une pile, il repose sur une conversion réversible d'énergie : l'accumulateur se charge et se décharge.
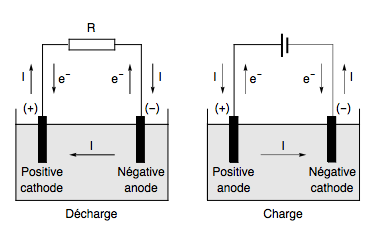
Fig. 2 – charge et décharge d'un accumulateur.
source : Wikipédia
Les équations lors de la charge s'écrivent :
| 1/2 équation électronique : | \(Pb^{2+} + SO_4^{2-} + 2\text{ } H_2O \rightarrow PbO_2 + HSO_4^{2-} + 3\text{ } H^{+} + 2\text{ } e^{-}\) | |
| 1/2 équation électronique : | \(Pb^{2+} + SO_4^{2-} + H^{+} + 2\text{ } e^{-} \rightarrow Pb + HSO_4^{2-}\) | |
| équation-bilan : | \(2\text{ } Pb^{2+} + 2\text{ } SO_4^{2-} + 2\text{ } H_2O \rightarrow Pb + PbO_2 + 2\text{ } HSO_4^{2-} + 2\text{ } H^{+}\) |
Les coefficients stoechiométriques nous indiquent dans quelle proportion les réactifs, les produits et la quantité d'électrons interviennent lors de la réaction.
Bilan de matière : deux moles d'ions plomb \(Pb^{2+}\) produisent une mole de \(Pb\) et une mole de \(PbO_2\). Au cours de la tranformation chimique deux moles d'électrons ont circulées.
\[ { Q = n_{e^{-}} \times N_A \times e = n_{e^{-}} \times F } \]\( { F = N_A \times e = 96500 \text{ } C.mol^{-1} } \)
or
\[ { Q = I \times Δt = n_{e^{-}} \times F } \]L'énergie stockée dans l'acculateur vaut :
\[ { ΔE = U \times Q = U \times n_{e^{-}} \times F } \]III - Piles à combustible
La pile à combustible produit de l'électricité en consommant de manière irréversible ses réactifs. Un apport continu de réactif est alors nécessaire. En ce sens on « recharge » la pile.
Exemple. La pile à combustible à membrane échangeuse de protons.
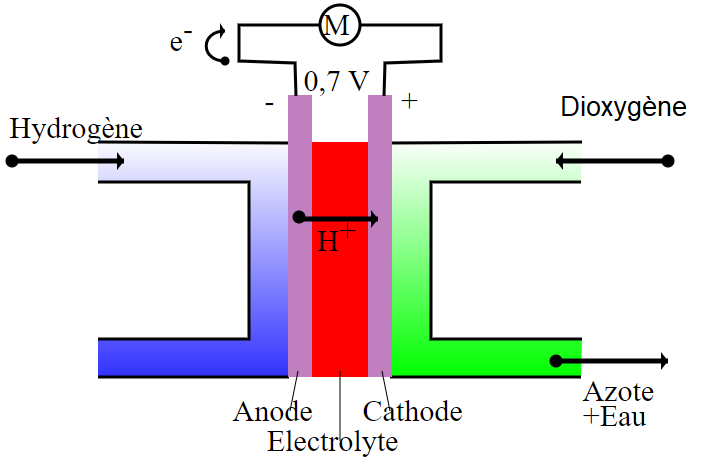
Fig. 3 – production d'électricité à l'aide d'une pile à combustible.
source : Wikipédia
Les équations qui décrivent le fonctionnement de la pile à combustible sont :
| 1/2 équation électronique : | \(H_2 \rightarrow 2\text{ } H^{+} + 2\text{ } e^{-}\) | |
| 1/2 équation électronique : | \(O_2 + 4\text{ } H^{+} + 4\text{ } e^{-} \rightarrow 2\text{ } H_2O\) | |
| équation-bilan : | \(2\text{ } H_2 + O_2 \rightarrow 2\text{ } H_2O\) |






